Léčba psoriatické artritidy - komentář k aktuálním doporučením EULAR
03/2021
MUDr. David Suchý, Ph.D.; MUDr. Jan Voříšek
Oddělení klinické farmakologie FN Plzeň
SOUHRN
Cílem těchto doporučení je poskytnout revmatologům, pacientům a dalším zúčastněným stranám shodu ohledně farmakologické léčby psoriatické artritidy a strategií k dosažení optimálních výsledků na základě kombinace důkazů a konsenzuálního znaleckého posudku.1 Bylo definováno pět zastřešujících principů a bylo vyvinuto deset doporučení zohledňujících artikulární a mimokloubní projevy psoriatické artritidy.
Klíčová slova
psoriatická artritida, léčba, EULAR
SUMMARY
These recommendations are intended to provide rheumatologists, patients, and other stakeholders with a consensus on the pharmacological treatment of psoriatic arthritis and strategies to reach optimal outcomes, based on combining evidence and expert opinion.1 Five overarching principles were defined Ten recommendations were developed accounting for articular and extra-articular manifestations of psoriatic arthritis.
Key words
psoriatic arthritis, treatment, EULAR
Celý článek je dostupný pouze pro předplatitele
Staňte se pravidelným odběratelem našeho časopisu Revue Farmakoterapie...
ÚVOD
Psoriatická artritida (PsA) představuje heterogenní chronické zánětlivé onemocnění, které se řadí podle koncepce spondyloartritid mezi spondyloartritidy s převahou periferního postižení. Jedná se o zánětlivé kloubní onemocnění doprovázející psoriázu a vyskytující se přibližně u 20 % nemocných s lupénkou. Projevy onemocnění zahrnují jak muskulosketální postižení, tak extraskeletální projevy (zejména kožní, střevní, postižení nehtů či očí). Aktivní chronická PsA je spojena s vyšším výskytem kardiovaskulárních, psychologických a metabolických komorbidit, které společně s muskulskeletálními projevy onemocnění významně ovlivňují kvalitu života nemocných a zkracují délku dožití. V poslední době se prohlubují znalosti o etiopatognezi choroby a současně se objevují i nové léky, které cíleně zasahují do klíčových patogenetických dějů.2 Aktualizace doporučení odborné společnosti European League Against Rheumatism (EULAR) z roku 2019 pro léčbu a monitoraci PsA odráží recentní důkazy, zavedení nových léčiv a konsensuální stanovisko expertního panelu, obsahující šest zastřešujících principů a dvanáct doporučení.1
ÚSTŘEDNÍ PRINCIPY A-F
A. Psoriatická artritida je heterogenní a potenciálně závažné onemocnění, které může vyžadovat multioborový přístup.
B. Léčba pacientů s psoriatickou artritidou by měla cílit na nejlepší dostupnou péči. Musí vycházet ze společného rozhodnutí pacienta a revmatologa a brát v úvahu účinnost, bezpečnost a náklady na léčbu.
C. Revmatologové jsou specialisté, kteří by měli primárně léčit muskloskeletální manifestace u pacientů s psoriatickou artritidou; v případě přítomnosti klinicky významného postižení kůže by měli na diagnóze a léčbě spolupracovat revmatolog a dermatolog.
D. Primárním cílem léčby pacientů s psoriatickou artritidou je dosáhnout prostřednictvím kontroly příznaků maximální kvality života související se
zdravím, předcházet strukturálnímu poškození, dosáhnout normálního fungování a sociální participace; důležitou komponentou k dosažení těchto
cílů je odstranění zánětu.
E. Při léčbě pacientů s psoriatickou artritidou je třeba zohlednit každou muskuloskeletální manifestaci a patřičně přizpůsobit léčebná rozhodnutí.
F. Při léčbě pacientů s psoriatickou artritidou je třeba vzít v úvahu jiné než muskuloskeletální manifestace (kůže, oči a gastrointestinální trakt); stejně tak
by mělo být přihlédnuto ke komorbiditám, jako jsou metabolický syndrom, kardiovaskulární onemocnění nebo deprese.1
DOPORUČENÍ
- Cílem léčby by mělo být dosažení remise nebo alternativně nízké aktivity onemocnění pravidelným hodnocením aktivity onemocnění a vhodnou úpravou terapie.
- Nesteroidní protizánětlivé léky mohou být použity ke zmírnění muskuloskletálních známek a příznaků.
- Lokální injekce glukokortikoidů by měly být u psoriatické artritidy považovány za doplňkovou terapii; systémové glukokortikoidy je možno použít s opatrností a v nejnižší účinné dávce.
- U pacientů s polyartritidou by měla být rychle zahájena terapie konvenčními syntetickými chorobu modifikujícími antirevmatickými léky (conventional synthetic disease modifying antirheumatic drugs, csDMARD) jako methotrexát, sulfasalazin nebo leflunomid) s preferencí methotrexátu u pacientů s relevantním postižením kůže.
- U pacientů s monoartritidou nebo oligoartritidou, zejména u těch se špatnými prognostickými faktory, jako jsou přítomné strukturální poškození, vysoké hodnoty sedimentace erytrocytů a C-reaktivního proteinu, daktylitida a postižení nehtů, by mělo být zváženo podání csDMARD.
- U pacientů s periferní artritidou a nedostatečnou odpovědí na nejméně jeden csDMARD by měla být zahájena terapie biologickými chorobu modifikujícími antirevmatickými léky (biological disease modifying antirheumatic drugs, bDMARD; v případě relevantního postižení kůže je možné preferovat inhibitor interleukinu (IL) 17 nebo IL-12/23.
- U pacientů s periferní artritidou a nedostatečnou odpovědí na nejméně jeden csDMARD a nejméně jeden bDMARD, nebo když podání bDMARD není vhodné, lze zvážit podání inhibitoru Janusových kináz.
- U pacientů s mírným onemocněním a nedostatečnou odpovědí na nejméně jeden csDMARD, u nichž není vhodné podání bDMARD ani inhibitorů Janusových kináz, lze zvážit podání inhibitorů fosfodiesterázy 4.
- U pacientů s jednoznačnou entezitdou a nedostatečnou odpovědí na nesteroidní antiflogistika (nonsteroidal antiinflammatory drugs, NSA) nebo lokální injekce glukokortikoidů by měla být zvážena terapie bDMARD.
- U pacientů s převážně axiálním onemocněním, které je aktivní a nereaguje dostatečně na NSA, by měla být zvážena terapie bDMARD, což je podle současné praxe inhibitor tumor nekrtizujícího faktoru a (tumor necrosis factor alpha, TNF-a). V přítomnosti významného postižení kůže je možné upřednostnit inhibitor IL-17.
- U pacientů, kteří nedosáhnou adekvátní odpovědi na konkrétní bDMARD nebo jej netolerují, by mělo být zváženo převedení na jiný bDMARD nebo na cílený syntetický chorobu modifikující antirevmatický lék (targeted synthetic disease modifying antirheumatic drugs, tsDMARD), včetně přechodu na jiný lék v rámci dané skupiny.
- U pacientů v strvalé remisi je možno zvážit opatrně snižování dávky nasazených DMARD.1
Komentář k doporučením
Koncept léčby k cíli (treat-to-target) se v revmatologii rychle etabloval. Je definován jako léčebná strategie doporučující agresivní přístup k dosažení a udržení opakovaně měřeného specifického cíle - remise nebo nízké klinické aktivity onemocnění.3
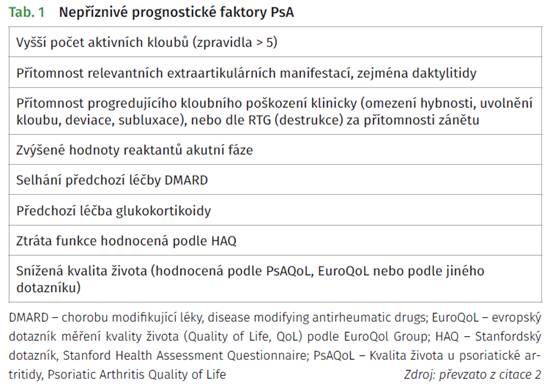
S tím souvisí princip těsné monitorace pacienta, pravidelných kontrol adjustace léčby podle jeho aktuálního stavu; nečeká se na progresi onemocnění. Tomu v praxi pomáhají i použitelné nástroje pro hodnocení aktivity a progrese onemocnění. V případě PsA se cíl léčby liší podle dominantního postižení (artritida, axiální postižení, entezitida, daktylitida) (tab. 1). Cílem je dosažení remise u časné PsA nebo nízké aktivity onemocnění (u dlouhotrvající PsA). Oproti doporučením z roku 2015 je vypuštěna minimální aktivita onemocnění jako cíl léčby. Remise je chápána jako nepřítomnost známek zánětu, není doporučen žádný konkrétní nástroj k měření aktivity PsA.1
Léčba PsA
Léčba PsA je členěna do čtyř fází (linií)
První linie
Do první linie je zařazena terapie NSA spolu s příležitostnou aplikací intraartkulárních glukokortikoidů.
- Tato léčba může být dostačující u lehkých, nedestruktivních forem onemocnění.1,2
- NSA mohou být tedy užita u mírných forem artritidy a čistě axiálních forem.
- Chybí důkazy o účinnosti NSA na entezitidy, kožní syndrom neovlivňují vůbec.1
- Nesteroidní antirevmatika by měla být v období aktivity onemocnění podávána v plné dávce, po snížení aktivity je možno pokračovat s podáváním NSA podle potřeby.
- Délka monoterapie u PsA s přetrvávajícími známkami zánětu by neměla trvat déle než měsíc (v předchozí verzi byl tento interval tři měsíce).
- V případě dominantních axiálních symptomů nebo entezitidy může být monoterapie NSA prodloužena na tři měsíce, pokud po čtyřech týdnech léčby dojde ke zmírnění symptomů.4
- Glukokortikoidy v kontextu aktuálních doporučení jsou chápány jako doplňková terapie; k aplikaci intrartikulárně, do šlachových pochev nebo k bolestivým entezím jsou u PsA plně indikovány.
- U oligoartikulárních forem PsA mohou být spolu s NSA jedinými léčivy, která dostačují pro kontrolu aktivity lehčích forem onemocnění.2
Systémová kortikoterapie má být užívána s opatrností a při užití nejnižší účinné dávky glukokortikoidů. Jedná se o terapii, která má být použita pouze krátkodobě, není doporučena pro terapii axiálních forem onemocnění.4
Druhá linie
V druhé linii farmakoterapie PsA jsou zařazeny konvenční DMARD.
Konvenční DMARD jsou doporučeny jako chorobu modifikující léky první linie. To reflektuje názor odborníků v rámci pracovní skupiny, kteří zvažovali přínosy a rizika csDMARD, a to zejména methotrexát, v první linii oproti bDMARD, a to i vzhledem k jejich nízké ceně. Oproti starším doporučením zde nebyl zaznamenán významnější názorový posun, nicméně došlo k upřesnění postavení methotrexátu. I přes nejednoznačné výsledky starších klinických hodnocení, zůstává methotrexát zlatým standardem z několika důvodů:1
- Methotrexát je v léčbě PsA široce používán, což dokazují data z registrů i observačních studií, a vykazuje dobré setrvání na léčbě.
- Methotrexát je účinný v kontrolních ramenech většiny klinických studií s biologickými přípravky.
- Dokumentován je signifikantní účinek podávání methotrexátu na kožní postižení.5
- Recentní studie SEAM-PsA prokázala velmi dobrý účinek methotrexátu v porovnání s etanerceptem. Methotrexát překvapivě prokázal účinnost i na daktylitidy, nikoliv však na entezitidy. Za optimální dávku methotrexátu je považována dávka 25 mg týdně.1
- Alternativně lze místo methotrexátu použít leflunomid nebo sulfasalazin.6 Použití cyklosporinu A není mezi léky druhé linie uvedeno.
- Doporučení neřeší kombinační léčbu více csDMARD.
Aktuální doporučení kladou větší váhu na rozlišení polyartikulárních (pět nebo více aktivních) kloubů a oligoartrikulární a monoartrikulární formy PsA s ohledem na horší prognostickou povahu polyartritidy.
- pacienti s polyartritidou by měli být léčeni csDMARD buď jako lékem první volby, nebo po krátkém cyklu NSA nepřesahujícím dva týdny.1
Třetí linie
Ve třetí linii jsou zařazeny bDMARD, které jsou indikovány tam, kde nebylo dosaženo terapeutického cíle v druhé linii, dále u převládající axiální symptomatologie nebo u převládajících entezitid při selhání léků z první linie (NSA, lokální glukokortikoidy).
Indikovat biologickou léčbu v případě periferní artritidy lze, pokud:
- Nedošlo k poklesu aktivity při léčbě csDMARD (methotrexát, leflunomid, sulfasalazin) během tří měsíců a k dosažení cíle léčby do šesti měsíců.
- U pacientů s absencí negativních prognostických faktorů či s mírnou aktivitou lze připustit léčebný pokus s druhým csDMARD.
- Podávání biologických léčiv již v první linii (tj. s vynecháním u pacientů s vysokou aktivitou / přítomností negativních prognostických faktorů) není doporučeno s ohledem na potvrzenou vysokou účinnost methotrexátu (studie SEAM-PsA).1
- V případě dominujícího axiálního postižení nebo entezitid se doporučuje časné zavedení bDMARD vzhledem k absenci efektu csDMARD na tyto projevy PsA.
- Biologická léčba většinou doplňuje stávající terapii csDMARD, tzv. add on princip.
Zatím co se v textu doporučení z roku 2015 uvádělo, že je „obvyklou praxí“ zahájit biologickou léčbu inhibitory TNF-a (přednostně před jinými bDMARD), aktuální doporučení již nerozlišuje mezi jednotlivými skupinami (inhibitory TNF-a, inhibitory IL-12/23 a IL-17).
- Literární rešerše potvrdila účinnost inhibitorů TNF-a v terapii PsA, včetně dlouhodobých údajů o bezpečnosti těchto léčivých přípravků.7,8 Biologická léčba bDMARD zaměřená na inhibici IL-12/23 a IL-17 prokázala srovnatelnou dlouhodobou účinnost i dobrý bezpečnostní profil.
- Přímá studie s ixekizumabem v porovnání s inhibitorem TNF-a adalimmabem prokázala ekvivalentní účinnost ixekizumabu a adalimumabu na muskuloskeletální projevy PsA.9
Účinnost ustekinumabu (inhibitor IL-12/23) se v klinických studiích jevila jako numericky nižší, observační údaje však naznačují podobné velikosti odpovědi ve srovnání s TNF-a. V současné době chybějí důkazy o účinnosti ustekinumabu u axiálního postižení. Recentní studie s biologickými látkami zaměřené na podjednotku IL-23p19 (guselkumab, risankizumab, tildrakizumab) se jeví jako povzbudivé a klinická hodnocení u psoriázy prokázala vynikající účinnost.10-14
Další možností léčby PsA zahrnuje podání tsDMARD. Léčba tsDMARDS (inhibitory Janusových kináz) je indikována:
- U pacientů, u kterých selhala léčba jedním csDMARD a jedním bDMARD, popř. tam, kde podání bDMARD není vhodné.
- Cílené syntetické tsDMARD vykazují účinnost na artritidu srovnatelnou s inhibitory TNF-a; účinek na psorizu je numericky nižší.1
Apremilastperorální inhibitor fosfdiesterázy 4 - je indikován u pacientů s PsA v případě selhání csDMARD a pokud použití biologických léků nebo inhibitorů Janusových kináz není vhodné nebo je kontraindikováno. Podání apremilastu se jeví jako vhodné u mírných, spíše oligoartikulárních forem PsA s nízkou aktivitou a lehkým kožním postižením.15
Guidelines se rovněž věnují léčbě entzitid a doporučují, aby lékaři s jistotou odlišovali fibromyalgii od entezitidy. Entezitida má být jednoznačně potvrzena (bolestivost, přítomnost otoku v místě enteze, popř. nález při ultrasonografickém vyšetření).
- V první linii léčby entezitid je doporučeno podání NSA, popř. lokální aplikace glukokortikoidů. Biologika csDMARD jsou v léčbě entezitidy neúčinná.
- Pokud terapie v první linii selže či léky první linie nelze nadále použít, je indikována biologická léčba.
- Při léčbě entezitid jsou všechna biologika postavena na stejnou úroveň, inhibitory TNF-a nejsou preferovány.
U pacientů s převážně axiálním onemocněním, které je aktivní a nereaguje dostatečně na NSA, by měla být zvážena terapie bDMARD, což je podle současné praxe inhibitor TNF a nebo inhibitory IL-17 v případě významného kožního postižení.
- V přítomnosti současného idiopatikého střevního zánětu nebo uveitidy je preferováno použití inhibitorů TNF-a.
- Ustekinumab není v léčbě axiálního postižení účinný.
V případě selhání biologické léčby prvním biologikem lze přejít na jiné bDMARD nebo tsDMARD.
- Změna biologické léčby má probíhat v rámci jedné třídy biologik (tj. např. inhibitory TNF-a).
- Při případném selhání druhého biolgika je doporučena změna léčby (tzv. switch) na bDMARD s jiným mechanismem účinku.
- Problémem je omezené množství dat, respektive data jsou dostupná pouze pro změny léčby v rámci inhibitorů TNF-a.1
U pacientů v setrvalé remisi je možno zvážit opatrné snižování dávky podaných DMARD.
- Detrakce dávky DMARD má být zvážena v případě kompletní remise přetrvávající minimálně po dobu šesti měsíců.16
- Cílem je najít nejmenší ještě účinnou dávku DMARD (omezení nežádoucích účinků a nákladů na léčbu).
- Problémem je nedostatek dat z klinických studií.
SHRNUTÍ
Aktualizace, která odráží recentní důkazy, zavedení nových léčiv a konsenzuální stanovisko expertního panelu, obsahuje šest zastřešujících principů a dvanáct doporučení. Za klíčové aspekty považuje EULAR stanovení cíle léčby a sdílené rozhodování s nemocným. Novým principem je zaměření se na heterogenitu PsA. Pokud se týká terapie, nově byly do léčebného algoritmu začleněny inhibitory IL-12/23 a IL-17, inhibitory Janusových kináz a inhibitory fosfodiesterázy 4. Léčbou první volby zůstávají NSA následované csDMARD, zejména methotrexátem (preferován je jako „zlatý standard“ a u kožního postižení), alternativně sulfasalazinem či leflnomidem. Tyto přípravky by však měly být lékem první volby u jedinců s PsA a projevy polyartritidy či periferní artritidy. Pokud dojde k selhání alespoň jednoho konvenčního syntetického léku, doporučen je přechod na biologika, jako jsou inhibitory TNF-a, IL-17 nebo IL-12/23. Poslední dvě jmenovaná v této skupině by měla být upřednostněna u nemocných s kožními projevy. Nejsou-li biologické přípravky vhodné nebo nedojde-li k adekvátní odpovědi na tuto terapii, nabízí se podání csDMARD, k nimž se řadí inhibitory Janusových kináz. Pokud všechny uvedené léčebné možnosti selžou, lze u pacientů s mírnou oligoartritidou či monoartritidou nebo s limitovaným kožním postižením indikovat inhibitor fosfodiesterázy 4 (apremilast). Doporučení rovněž zdůrazňují význam daktylitidy jako negativního prognostického faktoru a doporučují, aby lékaři s jistotou odlišovali fibromyalgii od entezitidy. U jedinců s PsA v remisi doporučují s velkou opatrností přistoupit ke snižování dávky DMARD.
LITERATURA
- Gossec L, Baraliakos X, Kerschbaumer A, et al. EULAR recommendations for the management of psoriatic arthritis with pharmacological therapies: 2019 update, Ann Rheum Dis 2020;79:700-712.
- Štolfa J. Biologická léčba psoriatické artritidy. Vnitř Lék 2018;64:127-135.
- Gorlier C, Orbai A-M, Puyraimond-Zemmour D, et al. Comparing patient-perceived and physician-perceived remission and low disease activity in psoriatic arthritis: an analysis of 410 patients from 14 countries. Ann Rheum Dis 2019;78:201-208.
- Van der Heijde D, Ramiro S, Landewé R, et al. 2016 update of the ASAS-EULAR management recommendations for axial spondyloarthritis. Ann Rheum Dis 2017;76:978-991.
- Carrascosa JM, de la Cueva P, Ara M, et al. Methotrexate in moderate to severe psoriasis: review of the literature and expert recommendations. Actas Dermosifiliogr 2016;107:194-206.
- Ramiro S, Smolen JS, Landewé R, et al. Pharmacological treatment of psoriatic arthritis: a systematic literature review for the 2015 update of the EULAR recommendations for the management of psoriatic arthritis. Ann Rheum Dis 2016;75:490-498.
- Hellgren K, Dreyer L, Arkema EV, et al. Cancer risk in patients with spondyloarthritis treated with TNF inhibitors: a collaborative study from the ARTIS and DANBIO registers. Ann Rheum Dis 2017;76:105-111.
- Costa L, Caso F, Del Puente A, et al. Incidence of malignancies in a cohort of psoriatic arthritis patients taking traditional disease modifying antirheumatic drug and tumor necrosis factor inhibitor therapy: an observational study. J Rheumatol 2016;43:2149-2154.
- Mease PJ, Smolen JS, Behrens F, et al. A head-to-head comparison of the efficacy and safety of ixekizumab and adalimumab in biological-naive patients with active psoriatic arthritis: 24-week results of a randomised, open-label, blinded-assessor trial. Ann Rheum Dis 2020;79:123-131.
- Deodhar A, Gottlieb AB, Boehncke W-H, et al. Efficacy and safety of guselkumab in patients with active psoriatic arthritis: a randomised, double-blind, placebo-controlled,phase 2 study. Lancet 2018;391:2213-2224.
- Mease PJ, Kellner H, Morita A, et al. OP0307 efficacy and safety of risankizumab, a selective IL-23p19 inhibitor, in patients with active psoriatic arthritis over 24 weeks: results from a phase 2 trial. Ann Rheum Dis 2018;77:200-201.
- Blauvelt A, Papp KA, Griffiths CEM, et al. Efficacy and safety of guselkumab, an anti-interleukin-23 monoclonal antibody, compared with adalimumab for the continuous treatment of patients with moderate to severe psoriasis: results from the phase III, double-blinded, placeband active comparator-controlled voyage 1 trial. J Am Acad Dermatol 2017;76:405-417.
- Reich K, Armstrong AW, Foley P, et al. Efficacy and safety of guselkumab, an anti-interleukin-23 monoclonal antibody, compared with adalimumab for the treatment of patients with moderate to severe psoriasis with randomized withdrawal and retreatment: results from the phase III, double-blind, placeband active comparator-controlled voyage 2 trial. J Am Acad Dermatol 2017;76:418-431.
- Gordon KB, Strober B, Lebwohl M, et al. Efficacy and safety of risankizumab in moderate-to-severe plaque psoriasis (UltIMMa-1 and UltIMMa-2): results from two double-blind, randomised, placebo-controlled and ustekinumab-controlled phase 3 trials. Lancet 2018;392:650-661.
- U.S. National Library of Medicine. Efficacy, safety, and tolerability study of apremilast to treat early oligoarticular psoriatic arthritis. ClinicalTrials.gov, 13. 5. 2021. Dostupné na: https://clinicaltrials.gov/ct2/show/NCT03747939
- Smolen JS, Schols M, Braun J, et al. Treating axial spondyloarthritis and peripheral spondyloarthritis, especially psoriatic arthritis, to target: 2017 update of recommendations by an international Task force. Ann Rheum Dis 2018;77:3-17.