Siponimod vs. placebo u aktivní sekundárně progresivní roztroušené sklerózy: post hoc analýza studie fáze 3 EXPAND
ÚVOD
Roztroušená skleróza (RS) je chronické zánětlivé autoimunitní demyelinizační a neurodegenerativní onemocnění postihující centrální nervový systém. Po několika letech zhruba polovina pacientů s relaps remitentním průběhem přechází do stadia sekundární progrese. Sekundárně progresivní RS (SPRS) je charakterizována postupným nárůstem trvalého neurologického deficitu, dochází k vymizení období remisí a snižování frekvence relapsů. U 60-90 % pacientů se SPRS dochází k poklesu kognitivních funkcí. Patofyziologie SPRS není plně charakterizována, ale předpokládá se, že zahrnuje chronický zánět v centrálním nervovém systému a neurodegeneraci spojenou s vyčerpáním reparačních mechanismů myelinu, což vede k zániku neuronů. Aby byla léčba u pacientů se SPRS účinná, musí být zaměřena na periferní a centrální zánět a neurodegeneraci.
Prvním perorálním lékem registrovaným k léčbě aktivní SPRS je siponimod. Siponimod je selektivní agonista receptorů pro sfingosin-1 fosfát (sphingosine-1phosphate, S1P) s afinitou k podtypům S1P1 a S1P5. Účinnost a bezpečnost léčby siponimodem byla ověřena ve dvojitě zaslepené placebem kontrolované klinické studii EXPAND.
STUDIE EXPAND A POST HOC ANALÝZA
Studie EXPAND byla dvojitě zaslepená randomizovaná placebem kontrolovaná studie fáze 3 trvající 36 měsíců, která zkoumala účinnost, bezpečnost a snášenlivost siponimodu u pacientů se SPRS. Do studie byli zařazeni pacienti ve věku od 18 do 60 let se skóre EDSS (Expanded Disability Status Scale) 3,0-6,5 při screeningu (50 % pacientů s EDSS ≥ 6,0) a bez relapsu v anamnéze během předchozích tří měsíců, kteří byli randomizováni (v poměru 2 : 1) k perorálnímu podávání siponimodu v dávce 2 mg jednou denně nebo placeba.
Vzhledem k tomu, že siponimod je schválený pro léčbu aktivní SPRS, bylo třeba charakterizovat jeho účinnost a bezpečnost u pacientů s aktivní SPRS (≥ 1 relaps během dvou let před zahájením studie a/nebo ≥ 1 T1 gadolinium enhancující léze na magnetické rezonanci (MR) na počátku studie). Proto byla provedena post hoc analýza údajů účastníků studie s aktivní SPRS, u kterých byly hodnoceny stejné primární a sekundární cílové ukazatele a další vybrané cílové ukazatele, které byly předem specifikovány pro celkovou populaci účastníků studie EXPAND. Vzhledem k častému kognitivnímu postižení u pacientů se SPRS bylo třeba analyzovat změny v kognitivním výkonu (rychlosti kognitivního zpracování informací) v podskupině účastníků s aktivní SPRS.
VÝSLEDKY
Byly analyzovány údaje od 779 pacientů z celkových 1 645 respondentů (47,4 %), kteří vstoupili do studie EXPAND, kteří obdrželi alespoň jednu dávku studovaného léku a měli aktivní SPRS podle definičních kritérií. Celkem 621 (79,7 %) z nich studii dokončilo.
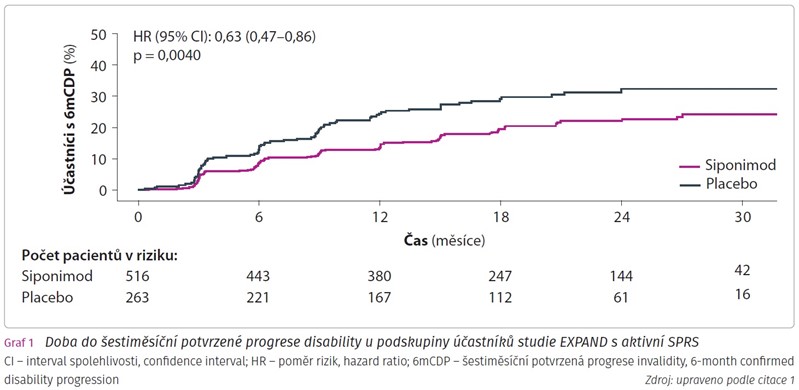
Primární cílový ukazatel byla doba do tříměsíční potvrzené progrese disability definovaná jako zvýšení skóre EDSS nejméně o 1,0, pokud výchozí skóre EDSS bylo v rozmezí 3,0-5,0, nebo nejméně o 0,5, pokud výchozí skóre EDSS bylo v rozmezí 5,5-6,5 potvrzené po třech měsících. Léčba siponimodem snížila riziko tříměsíční potvrzené progrese disability o 31 % ve srovnání s placebem. Sekundárním cílovým ukazatelem byla doba do šestiměsíční potvrzené progrese disability. Léčba siponimodem snížila riziko šestiměsíční potvrzené progrese disability o 37 % ve srovnání s placebem (graf 1), přičemž tento účinek byl konzistentní u účastníků s jakoukoli předchozí chorobu modifikující léčbou v jakémkoli období, předchozí léčbou interferonem kdykoli a interferonem jako poslední léčbou. V obou případech byl výsledek v porovnání s placebovou skupinou statisticky signifikantní.
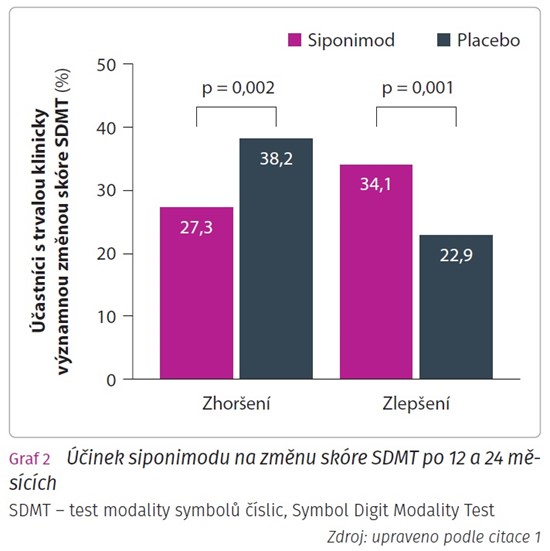
Testování kognitivních funkcí pomocí testu SDMT (Symbol Digit Modality Test) ukázalo rozdíl v kognitivním výkonu mezi oběma skupinami. Léčba siponimodem byla spojena se signifikantním zlepšením skóre SDMT (přičemž změna o ≥ 4 body byla považována za klinicky významnou). V placebové skupině byl pozorován trvalý pokles v počtu dosažených bodů v SDMT, zatímco pacienti užívající siponimod se kontinuálně zlepšovali a po 24 měsících léčby měli v průměru o 2,34 bodu více než při vstupním testování (graf 2). Siponimod zvýšil pravděpodobnost šestiměsíčního potvrzeného zlepšení SDMT oproti placebu (o 62 %; p = 0,007) a snížil riziko šestiměsíčního potvrzeného zhoršení SDMT (o 27 %; p = 0,060).
Velmi významný byl také účinek léčby siponimodem na aktivitu onemocnění při vyšetření MR. Léčba siponimodem byla spojena s menším nárůstem objemu T2 lézí (1 316,3 vs. 13,3 mm3; p <0,0001) a se snížením úbytku objemu mozku ve srovnání s placebem. Kromě toho více pacientů, kteří užívali siponimod, bylo při všech vyšetřeních MR po ukončení léčby bez T1 gadolinium enhancujících lézí (83,9 % vs. 54,3 %) a bez nových nebo zvětšujících se T2 lézí (44,8 % vs. 25,0 %).
Roční míra relapsů byla nižší ve skupině léčené siponimodem než ve skupině s placebem (0,093 vs. 0,171; snížení o 46 %), stejně jako doba do potvrzení prvního relapsu.
Nebyl pozorován žádný významný rozdíl v době do tříměsíčního potvrzeného zhoršení chůze o nejméně 20 % podle T25FW (timed 25foot walk).
 Změna skóre MSWS-12 (Multiple Sclerosis Walking Scale; zvyšující se skóre znamená zhoršující se schopnost chůze) oproti výchozímu stavu byla 2,54 u siponimodu a 5,15 u placeba (rozdíl mezi skupinami -2,60; p = 0,0494).
Změna skóre MSWS-12 (Multiple Sclerosis Walking Scale; zvyšující se skóre znamená zhoršující se schopnost chůze) oproti výchozímu stavu byla 2,54 u siponimodu a 5,15 u placeba (rozdíl mezi skupinami -2,60; p = 0,0494).
Výskyt nežádoucích účinků byl v obou skupinách srovnatelný. Celkem byly hlášeny u 86,8 % účastníků s aktivní SPRS, kteří užívali siponimod, a u 78,3 % účastníků, kteří užívali placebo. Odpovídající podíly nežádoucích účinků vedoucích k přerušení léčby byly 5,8 % ve skupině se siponimodem a 6,1 % ve skupině s placebem; u závažných nežádoucích příhod byly odpovídající podíly 15,1 % ve skupině se siponimodem a 15,6 % ve skupině s placebem.
DISKUSE
V této post hoc analýze účastníků s aktivní SPRS byl vliv siponimodu na snížení rizika progrese disability ve srovnání s placebem výraznější, než jaký byl pozorován v celkové populaci EXPAND. Bezpečnostní výsledky u účastníků s aktivní SPRS odpovídaly výsledkům pozorovaným u celkové populace EXPAND.
U pacientů s aktivní SPRS se pravděpodobnost trvalého zlepšení rychlosti kognitivního zpracování informací (≥ 4 body) zvýšila o 51 % a riziko trvalého zhoršení (≥ 4 body) se snížilo o 28 % při užívání siponimodu ve srovnání s placebem; u proporcionálně více účastníků s aktivní SPRS došlo k trvalému zlepšení (34 % vs. 23 %; p = 0,001) a proporcionálně méně pacientů zaznamenalo trvalé zhoršení (27 % vs. 38 %; p = 0,002) v rychlosti kognitivního zpracování informací u siponimodu než u placeba. To je v souladu se zjištěními v celkové populaci studie EXPAND, což naznačuje, že siponimod má potenciál oddálit nebo dokonce zvrátit kognitivní deficity související s rychlostí kognitivního zpracování informací u pacientů se SPRS. Kromě toho nedávno provedená analýza studie EXPAND ukázala, že pravděpodobnost zlepšení v rychlosti kognitivního zpracování informací je větší u účastníků s diagnózou s aktivní SPRS (62 %) než u účastníků s neaktivním onemocněním (19 %).
V souladu se zjištěními u celkové populace pacientů se SPRS ve studii EXPAND siponimod také snížil aktivitu zánětlivého onemocnění měřenou jako roční míru relapsů a aktivitu lézí na MR a míru úbytku objemu mozku (dosáhl statistické významnosti během prvních 12 měsíců a v průměru během 12. a 24. měsíce) v podskupině pacientů s aktivní SPRS. Další analýzy měření MR ukázaly výraznou účinnost siponimodu v celkové populaci v souladu s významnými účinky pozorovanými na objemu T2 lézí u aktivní i neaktivní SPRS. U účastníků s aktivní SPRS byla zaznamenána větší odezva v klinických výsledcích oproti celkové populaci a skupině bez aktivní SPRS. To naznačuje, že siponimod může působit prostřednictvím dvou (možná vzájemně propojených) patofyziologických cest ovlivňujících zánět a neurodegeneraci. Časné zahájení podávání siponimodu u pacientů s aktivní SPRS může představovat nejlepší příležitost k oddálení progrese fyzického postižení, zachování neurologické rezervy a potenciálnímu zlepšení kognitivního stavu.
ZÁVĚR
Závěrem lze říci, že příznivé účinky léčby siponimodem na klinické výsledky během základní doby trvání studie byly zřetelnější u účastníků s aktivní SPRS než v celkové populaci studie EXPAND. Tyto údaje v kombinaci s bezpečnostním profilem, který byl konzistentní u účastníků s aktivní SPRS a celkovou populací EXPAND (a konzistentní s profilem modulace S1P) podporují význam siponimodu v léčbě pacientů se SPRS.
LITERATURA
- Gold R, Piani-Meier D, Kappos L, et al. Siponimod vs placebo in active secondary progressive multiple sclerosis: a post hoc analysis from the phase 3 EXPAND study. J Neurol 2022;269:5093-5104.
Komentář
Doc. MUDr. Zbyšek Pavelek, Ph.D. / Neurologická klinika LF UK a FN v Hradci Králové
U více než 50 % pacientů s relabující-remitující roztroušenou sklerózou (RRRS) dojde během 15 až 20 let ke konverzi do sekundární progresivní roztroušené sklerózy (SPRS)1. Relapsy se u SPRS nevyskytují nebo jsou málo časté, přesto se postižení postupně zhoršuje. Relabující-remitující roztroušená skleróza je tedy charakterizována postupně narůstající disabilitou bez tendence k úpravě a ovlivňuje každodenní aktivity a schopnost práce. Vede ke snížení schopnosti chůze. Více než 90 % pacientů se SPRS vyžaduje do tří let od začátku progrese pomoc při chůzi.2 Až 80 % pacientů s SPRS má kognitivní poruchu.3 Nemocní popisují zhoršení vizuálních funkcí, funkcí horních končetin, častěji se vyskytují deprese, bolest, únava a močová inkontinence.4'5
Siponimod je perorální modulátor receptoru pro sfingosin-1-fosfát (sphingosine-1-phosphate, S1P) se selektivní aktivitou k podtypům S1P1 a S1P5. Receptor S1P1 (in vivo) ovlivňuje výstup lymfocytů z lymfatických uzlin, funkci astrocytů a mikroglie, embryonální kardiovaskulární a neuronální vývoj, vazomotorický tonus a endoteliální bariéry. Receptor S1P5 má potenciální účinek na myelinizaci a ovlivňuje prostupnost hematoencefalické bariéry.6 Siponimod je indikován k léčbě dospělých pacientů se SPRS s aktivním onemocněním doloženým relapsy nebo zánětlivou aktivitou pomocí zobrazovacích metod.
Tato post hoc analýza klinické studie fáze 3 EXPAND vznikla za účelem určit účinnost/bezpečnost siponimodu u aktivní SPRS (aSPRS). Do analýzy bylo zahrnuto 779 pacientů. Pacienti s aSPRS byli definováni přítomností ≥ 1 relapsu během dvou let před studií a/nebo ≥ 1 T1 gadolinium (Gd) enhancující lézí na magnetické rezonanci (MR) na počátku léčby. Užívali perorální siponimod (2 mg/den) nebo placebo po dobu až tří let.
V analýze byly hodnoceny jak klinické, tak paraklinické parametry (relapsy a disabilita, nález na MR, kognitivní funkce a bezpečnost léčby). Výstupy analýzy byly tříměsíční/šestiměsíční potvrzená progrese invalidity (6-month confirmed disability progression / 3-month confirmed disability progression, 3mCDP/6mCDP), tříměsíční potvrzené zhoršení o ≥ 20 % při hodnocení rychlosti chůze na vzdálenosti 25 stop (7,62 m) (timed 25-foot walk, T25FW), šestiměsíční potvrzené zlepšení/zhoršení v testu modality symbolů číslic (Symbol Digit Modalities Test, SDMT) (změna o ≥ 4 body), změna objemu T2 lézí (T2LV) oproti výchozímu stavu, počet T1 Gd enhancujících lézí při zahájení klinické studie a ve 24. měsíci a počet nových/zvětšujících se T2 lézí v průběhu všech klinických návštěv.
Siponimod snížil riziko 3mCDP o 31 % ve srovnání s placebem a riziko 6mCDP o 37 % v porovnání s placebem. Roční počet relapsů (annualized relapse rate, ARR) byl nižší ve skupině léčené siponimodem oproti skupině s placebem.
Je známo, že pacienti s roztroušenou sklerózou mají postiženo více kognitivních funkcí – exekutivní a vizuospaciální funkce, paměť, pozornost a řeč. Nejvíce postiženou oblastí je rychlost zpracování informací, která úzce souvisí s pracovní pamětí a komplexní pozorností.7 Léčba siponimodem byla spojena s benefitem v oblasti kognitivních funkcí, což bylo hodnoceno pomocí skóre SDMT (změna o ≥ 4 bodů byla považována za klinicky významnou). Průměrná změna skóre SDMT od výchozího stavu do 24. měsíce byla 0,79 u siponimodu a -1,55 u placeba. Siponimod rovněž signifikantně snížil riziko klinicky významného zhoršení v testu SDMT, které přetrvávalo během všech návštěv ve srovnání s placebem.
Z hlediska parametrů MR byla léčba siponimodem spojena s menším nárůstem T2LV a se snížením úbytku objemu mozku v porovnání s placebem. Léčba siponimodem byla spojena s menším počtem T1 Gd enhancujících lézí a menším počtem nových nebo zvětšujících se T2 lézí oproti placebu.
Nežádoucí příhody byly hlášeny u 86,8 % pacientů s aSPRS, kteří užívali siponimod, a u 78,3 % pacientů s aSPRS, kteří užívali placebo. Nežádoucí účinky vedly k ukončení léčby v 5,8 % ve skupině se siponimodem a v 6,1 % ve skupině s placebem.
Post hoc analýza ze studie fáze 3 EXPAND u pacientů s aSPRS prokázala přínos siponimodu u této skupiny pacientů jak z hlediska klinických, tak paraklinických parametrů. Podpořila správnost indikace léčby siponimodem u dospělých pacientů se SPRS s aktivním onemocněním doloženým relapsy nebo zánětlivou aktivitou pomocí zobrazovacích metod (gadolinium enhancující T1 léze nebo nová a zvětšující se T2 ložiska v obraze MR).
LITERATURA
- Lublin FD, Reingold SC. Defining the clinical course of multiple sclerosis: results of an international survey. National Multiple Sclerosis Society (USA) Advisory Committee on Clinical Trials of New Agents in Multiple Sclerosis. Neurology 1996;46:907-911.
- Scalfari A, Neuhaus A, Daumer M, et al. Onset of secondary progressive phase and long-term evolution of multiple sclerosis.J Neurol Neurosurg Psychiatry 2014;85:67-75.
- Papathanasiou A, Messinis L, Georgiou VL, et al. Cognitive impairment in relapsing remitting and secondary progressive multiple sclerosis patients: efficacy of a computerized cognitive screening battery. ISRN Neurol 2014;2014:151379.
- Gross HJ, Watson C. Characteristics, burden of illness, and physical functioning of patients with relapsing-remitting and secondary progressive multiple sclerosis: a cross-sectional US survey. Neuropsychiatr Dis Treat 2017;13:1349-1357.
- Beiske AG, Naess H, Aarseth JH, et al. Health-related quality of life in secondary progressive multiple sclerosis. Mult Scler 2007;13:386-392.
- Strub GM, Maceyka M, Hait NC, et al. Extracellular and intracellular actions of sphingosine-1-phosphate. Adv Exp Med Biol 2010;688:141-155.
- Benedict RH, Cookfair D, Gavett R, et al. B. Validity of the minimal assessment of cognitive function in multiple sclerosis (MACFIMS). J Int Neuropsychol Soc 2001;12:549-558.